Stabilité primaire
Comment l’optimiser pour une excellente Ostéointégration ?
Article scientifique rédigé par par Augustin Lerebours (PhD).
Introduction
Le succès à long-terme en implantologie dentaire nécessite l’évaluation de plus de 50 critères dentaires unique à la discipline [1]. L’objectif est d’obtenir et de maintenir une stabilité implantaire pérenne faisant face aux évènements biomécaniques et physiologiques continus et ponctuels, conditions essentielles au succès à long terme.
La stabilité implantaire se définie en deux temps :
– La stabilité primaire
Il s’agit de la résistance initiale aux micromouvements résultat du protocole d’insertion de l’implant. Elle dépend de l’engagement mécanique de l’implant dans la cavité osseuse, mais diminue dès les premiers stades de la cicatrisation.
– La stabilité secondaire
Il s’agit de l’ostéointégration, c’est-à-dire la stabilité mise en place par la néoapposition osseuse en contact avec l’implant par la formation de cristaux d’hydroxyapatite issue de l’activité métabolique des cellules osseuses. Elle l’augmente progressivement par la formation d’os néoformé. Elle est absente au moment de la pose de l’implant et augmente avec le temps
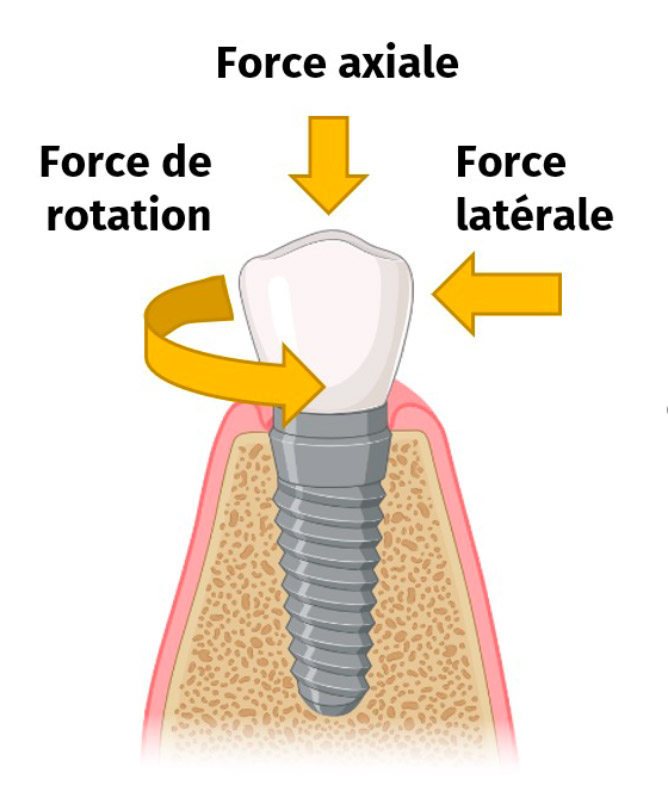
L’objectif in fine est d’atteindre une excellente ostéintégration. Elle est définie par Albrektson et al [2] comme un ancrage direct d’un implant par la formation de tissu osseux périphérique sans interposition de tissu fibreux à l’interface os-implant, fondation pour soutenir la prothèse. La stabilité de l’implant est une caractéristique requise de l’ostéointégration, puisque la formation d’os néoformé ne peut se faire qu’en repos mécanique. Il est défini comme l’absence de mobilité par la capacité de résistance de l’implant aux forces axiales, latérales et de rotation.
Ce principe n’est pas simplement une spécificité de l’implantologie dentaire mais plus largement de l’implantologie orthopédique et traumatologique par la mise en place de plaque de fixation et de plâtre. Dans ce contexte, la stratégie suèdoise de Bränemark consiste en une mise en charge différée car les sollicitations occlusales augmentent la mobilité potentielle et donc le succès de l’ostéointégration. Encore aujourd’hui, la mise en nourrice est considérée comme garante d’un taux de succès maximal.
Les patients demandent des traitements plus courts et moins d’interventions chirurgicales [3]. Une condition préalable fondamentale pour la mise en charge immédiate est une stabilité primaire substantielle de l’implant au moment de l’insertion (Cf. Figure 1).
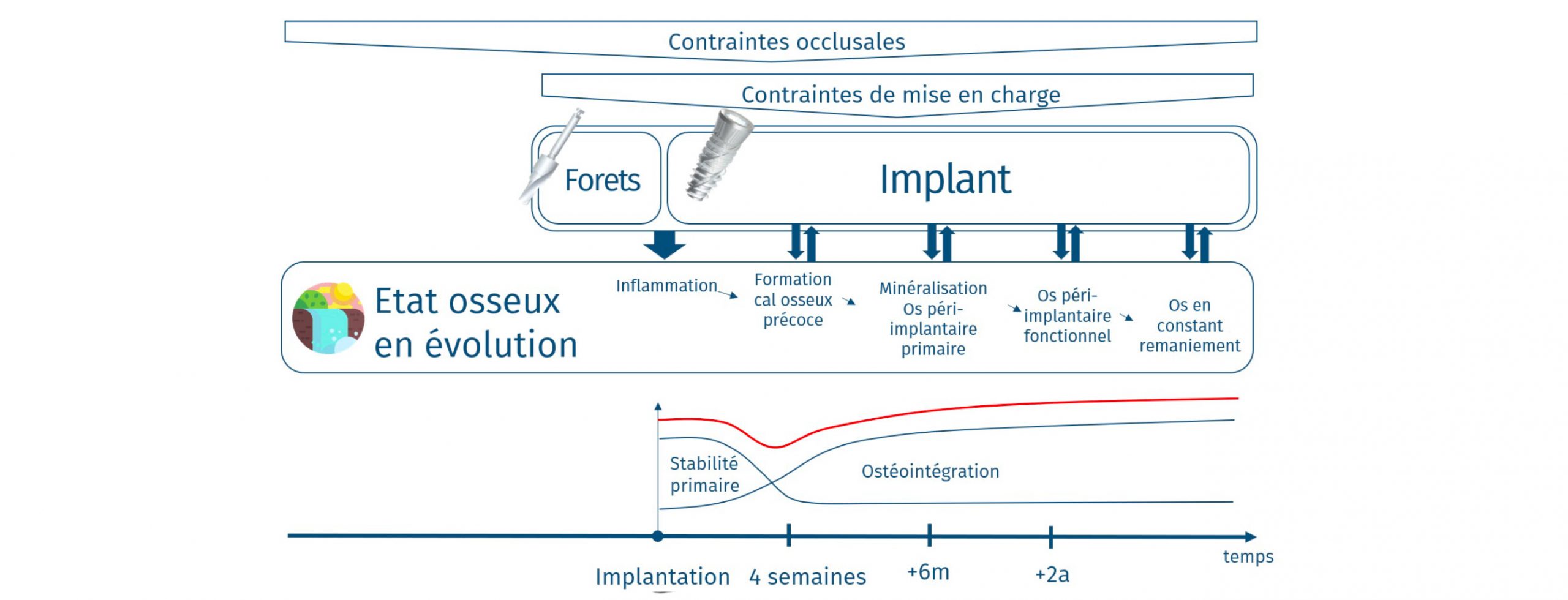
Figure 1 : Evolution de la stabilité implantaire en fonction de l’évolution de l’état osseux, de l’implant et des contraintes appliquées
Comment évaluer la stabilité primaire ?
Il existe deux méthodes pour évaluer la stabilité primaire :
– Le Torque
Il s’agit du module des forces rotationnelles et axiales lors de l’insertion. Cette valeur en N.cm reflète le contact tridimensionnel intime entre les lits osseux et la surface implantaire. Le torque ne permet pas d’évaluer l’évolution de la stabilité au cours du temps.
– L’analyse de la fréquence de résonnance
Elle consiste à appliquer une fréquence sur l’implant et d’analyser la vibration réflective. En effet cette dernière va être impacté par la rigidité de la mobilité de l’interface os/implant. Plus le contact est intime entre l’os et l’implant, plus la fréquence va augmenter et inversement. Autrement dit le déplacement des vibrations est plus rapide avec une forte liaison os/implant. Le quotient de stabilité de l’implant ISQ traduit cette analyse en valeur comprise entre 1 et 100 (Stabilité élevée > ISQ : 70, Stabilité modérée [60 et 69], Stabilité faible < 60).
Quelles sont les facteurs impactant la stabilité primaire ?
La stabilité primaire est influencée par 4 grands facteurs qu’il convient d’évaluer et de prendre en compte dans l’élaboration du plan de traitement :
- Le site implantaire
- Forces, mobilités et contraintes
- Protocole d’implantation
- Bioforme et état de surface de l’implant
1. Le site implantaire
L’os disponible est particulièrement important en implantologie. Il s’agit de l’architecture externe et volume de la zone édentée à considérer pour l’implant. Par ailleurs, l’os a une structure interne que l’on peut classer en termes de qualité. La qualité osseuse est mesurée par la densité osseuse, elle reflète les contraintes maximales que peuvent supporter l’os.
Sur le plan physiologique, la densité osseuse reflète également la cellularisation, en effet il existe une taille d’alvéole optimale pour l’angiogenèse et l’activité métabolique des cellules osseuses (ostéoblastes, ostéoclastes, ostéocytes).
Misch distingue quatre densités osseuses [1] :
Tableau 1 : Classification des densités osseuse par Misch
Cette classification est comparable à la sensation tactile de pénétration de matériaux aux densités équivalentes. Les protocoles de forage et l’insertion de l’implant dans de l’os D1 est comparable à la sensation de forage du chêne et de l’érable. L’os D2 est comparable au pin blanc et à l’épicéa. L’os D3 est comparable au mélèze. L’os D4 est comparable au polystyrène expansé.
La densité osseuse varie en fonction de la localisation (John et al). L’os D1 n’est pratiquement jamais observé dans la région maxillaire, il est néanmoins présent dans la région mandibulaire à hauteur de 8%. L’os D2 est le plus commun dans la mandibule. Plus de 50% des patients possède de l’os D2 dans la partie postérieure et antérieur de la mandibule. L’os D3 est le plus commun, notamment au maxillaire antérieur et postérieur. L’os D4 se trouve essentiellement au maxillaire postérieur à hauteur de 40%.
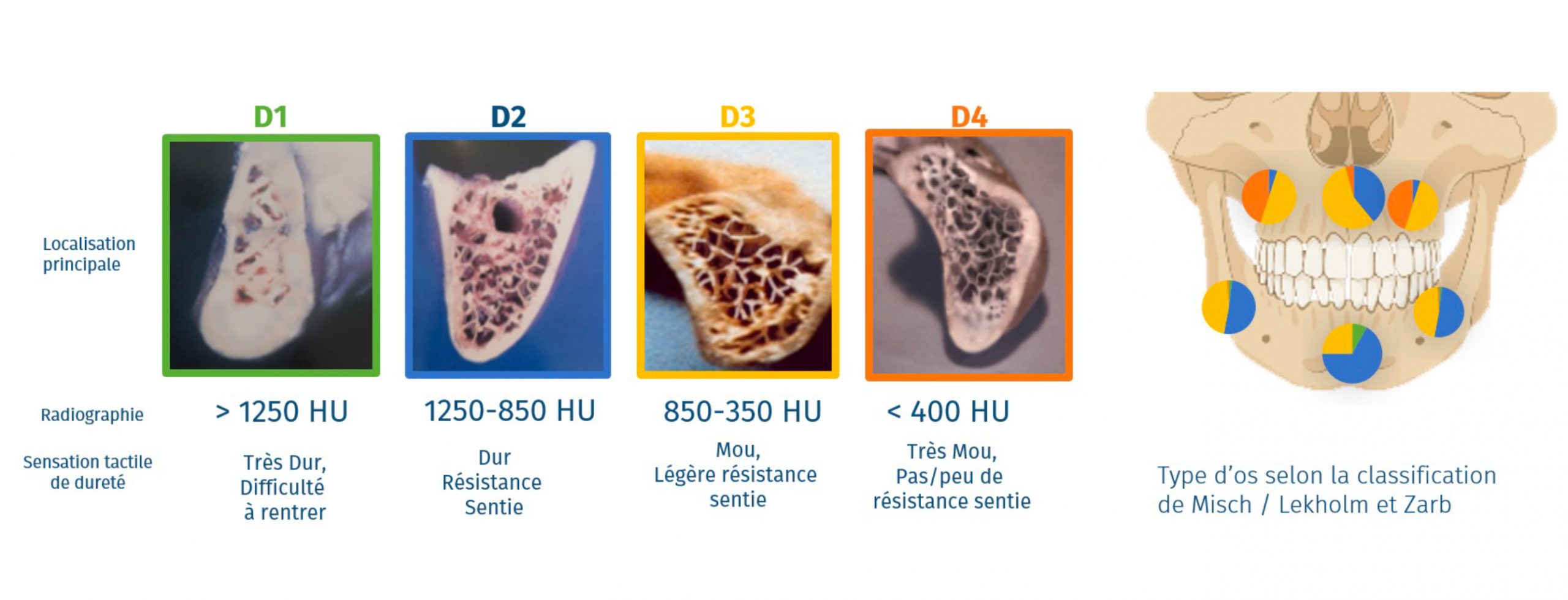
Figure 2 : Caractéristiques de densités osseuses selon la classification de Misch et localisation principale des types de densité osseuse (%)
Il est préférable de prévoir le plan de traitement en sous évaluant la densité osseuse, afin que la prothèse possède davantage de support (facteur de de sécurité).
Une détermination plus précise de la densité osseuse peut être évaluée par CTscan et/ou par sensation tactile grâce à l’ostéotenseur.
La densité osseuse est directement corrélée aux contraintes maximales que peuvent supporter l’os avant microfractures [4]. Entre l’os D1 et D4, la résistance maximale varie d’un facteur dix, l’os D2 présente 47 à 68% de résistance maximale en plus que de l’os D3.
Dans l’article de Turkyllmas et al [5], les auteurs montrent la corrélation entre la densité et la stabilité primaire par le biais de deux méthode de mesures précédemment décrites (Cf. Fig. 2)
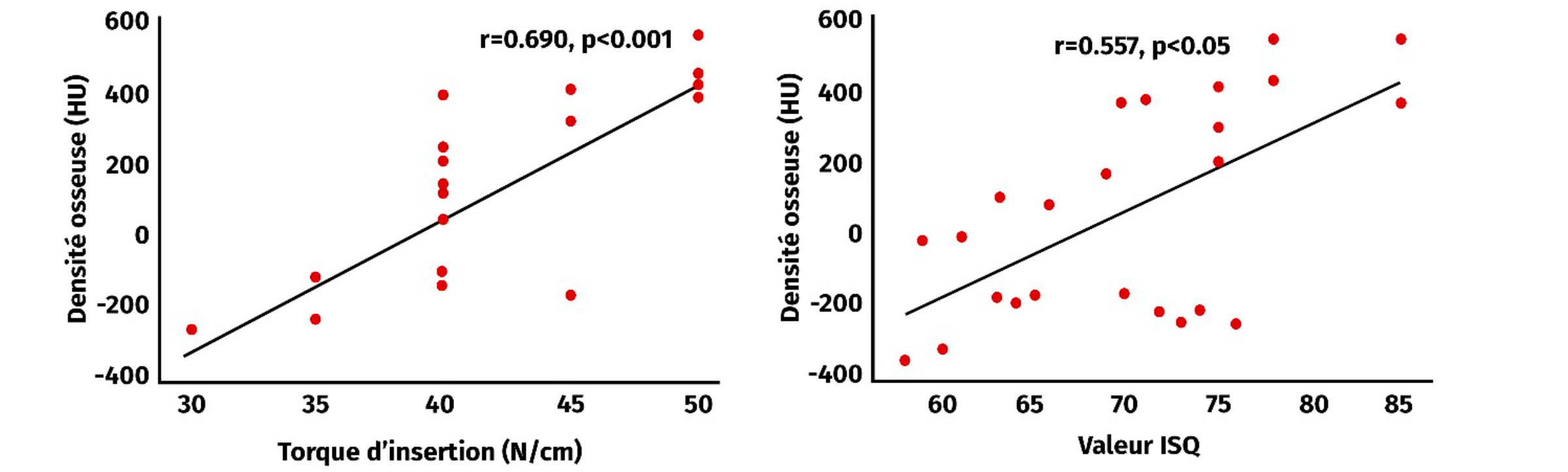
Figure 3 : Relation entre la densité osseuse et la stabilité implantaire par deux méthodes de mesure : la torque d’insertion et la valeur ISQ (fréquence de résonnance). Figure issue de l’article de Turkyllmaz et al. [5]
2. Forces, mobilité et contraintes
La densité osseuse initiale ne permet pas uniquement l’immobilisation mécanique de l’implant pendant la phase de cicatrisation mais permet également la distribution et la transmission des contraintes depuis la prothèse jusqu’à l’interface os/implant. La distribution des contraintes ne se fait qu’à partir du contact os/implant. De fait, la structure alvéolaire de l’os trabéculaire ne permet pas une dissipation homogène et contrôlée des forces exercées. Une faible surface de contact sera d’avantage contrainte mécaniquement pour une force exercée équivalente. La formule suivante traduit ce phénomène :
σ=F/S
σ∶Contrainte en MPa;F∶Force en N et S∶Surface en mm2
De fait, l’os D1 permettra une meilleure répartition des contraintes que de l’os D4 à force équivalente. Autrement dit, une plus grande quantité d’os est nécessaire pour un os D4 comparé à un os D1 pour des contraintes maximales équivalente.
La perte de l’os marginal et la perte des implants après leur mise en charge résulte de contraintes excessives au niveau de l’interface os/implant crestale. Ce phénomène peut être expliqué par les zones de contact inhérente aux densités osseuses. En effet les contraintes sont majoritairement situées au niveau des zones denses soit l’os crestal. Dans le cas de l’os D1, l’os est très corticalisé, les contraintes sont donc distribuées autour de l’implant. Cependant dans le cas de l’os D4, ce dernier présente une forte accumulation de contraintes au niveau crestal, car il s’agit de l’unique zone d’ancrage.
L’amplitude des contraintes au niveau crestal est donc dépendante du type d’os. Il est donc primordial d’évaluer la qualité de l’os notamment au niveau crestal (7-10mm) pour déterminer le plan de traitement implantaire (cf figure 4).
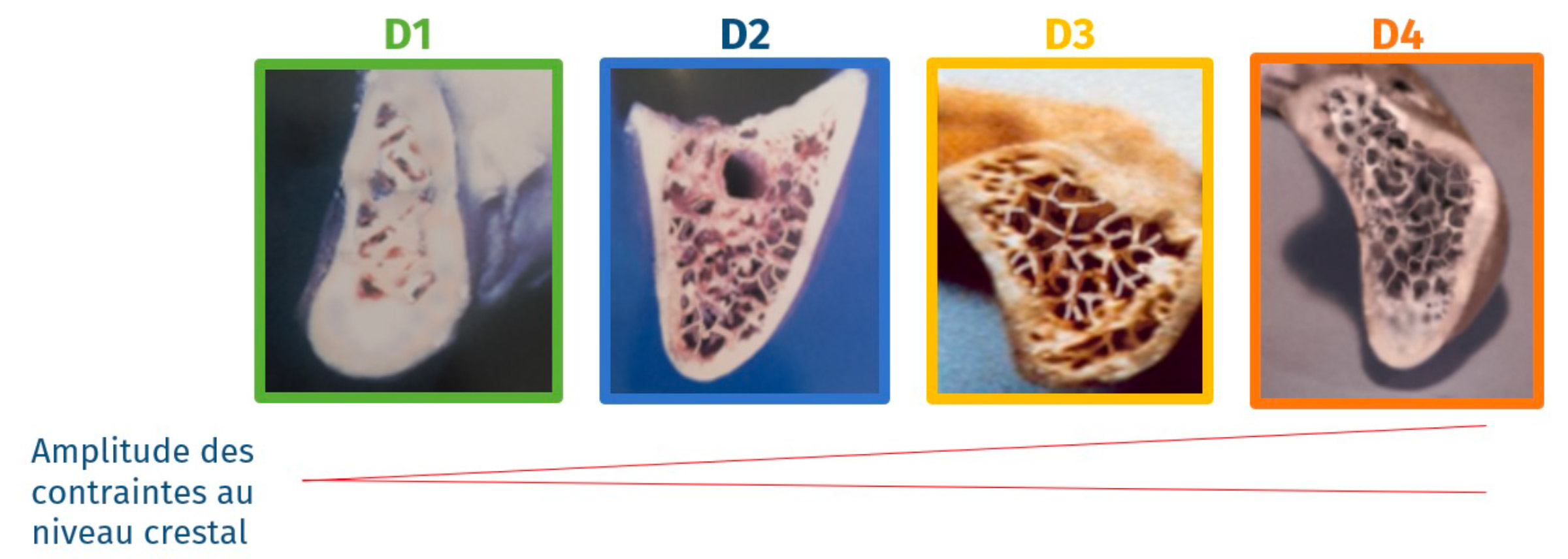
Figure 4 : Corrélation entre l’amplitude des contraintes au niveau crestal et la densité osseuse
Il convient d’évaluer les forces qui vont s’exercer sur le système c’est-à-dire l’orientation, la charge, le temps de contact journalier. Ces paramètres dépendent principalement du patient, qu’il convient d’estimer en fonction du poids, de l’âge, de la morphologie faciale, de l’état de la dentition et de ces pathologies.
Les charges appliquées sur le système sont ensuite dissipées sous forme :
- de contrainte,
- de mobilité,
- de déformation.
L’objectif est de réduire la dissipation sous forme de mobilité en deçà d’un certain seuil (<50µm). En effet la formation d’os néoformé est fragilisée par la mobilité du système. La différence de mobilité entre les dents naturelles (28-120µm) et les implants (5-50µm) s’explique par le ligament parodontal (cf Figure 5).
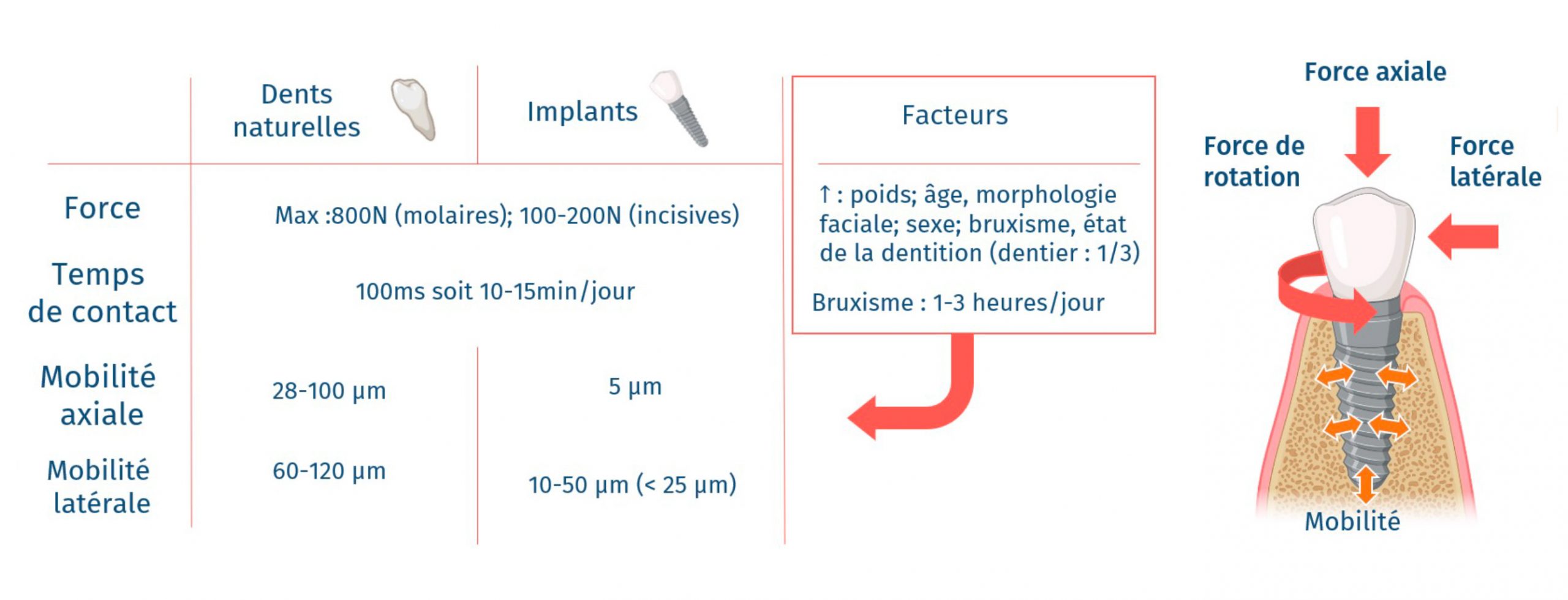
Figure 5 : Différences entre l’implant et la dent naturelle en termes de force, temps de contact et mobilité
A noter que l’absence de mobilité ne peut se faire que si les contraintes de chargement initiales sont supérieures aux contraintes fonctionnelles.
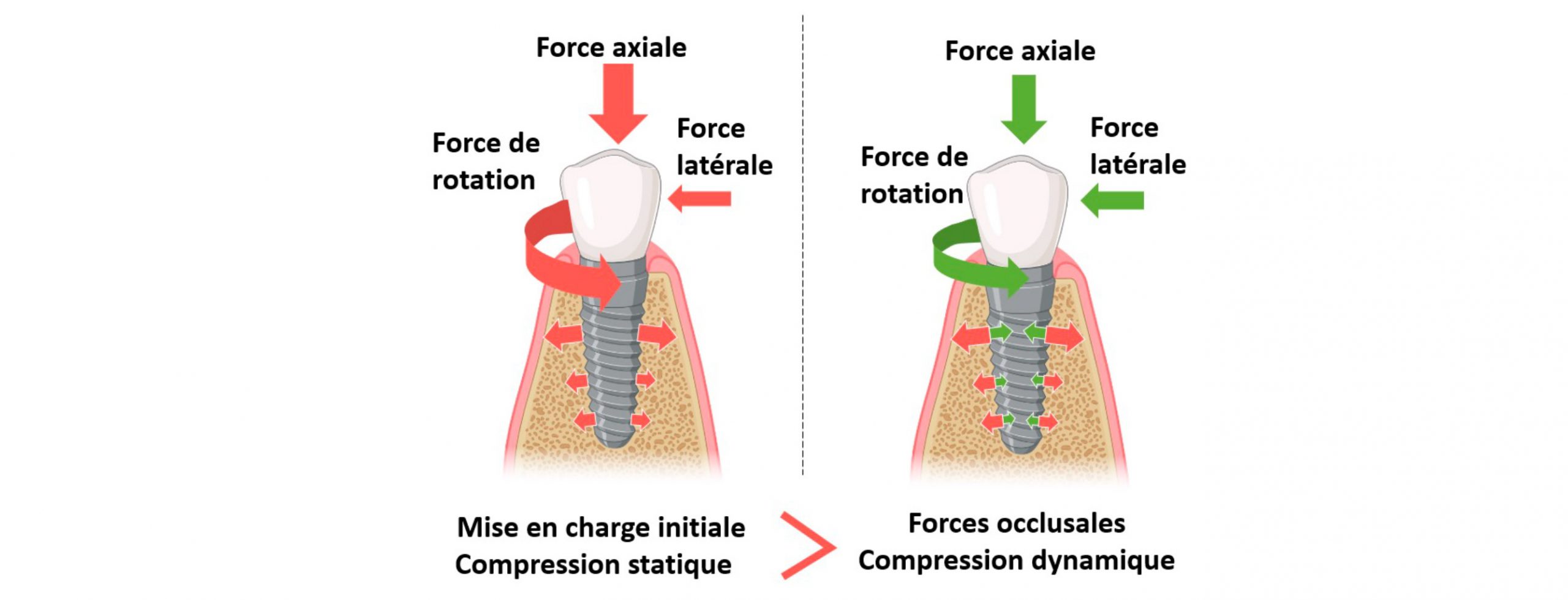
Figure 6 : Schéma explicatif pour éviter la mobilité en fonction des charges appliquées
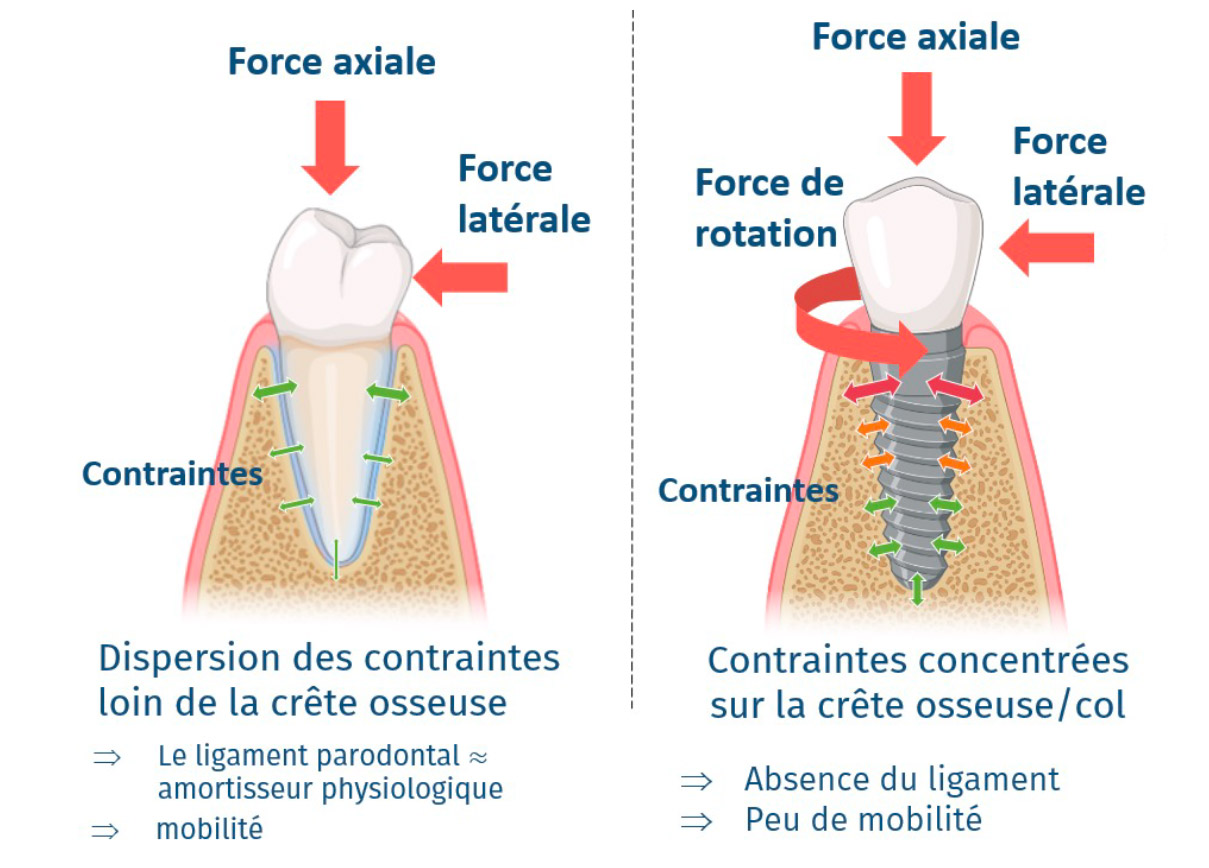
Figure 7 : Répartition des contraintes entre une dent naturel et un implant
Il permet une dispersion des contrainte au-delà de la région crestal en se déformant élastiquement, il s’agit d’un amortisseur physiologique permettant une certaine mobilité de la dent sans en affecter le tissu osseux. Dans le cas des implants dentaires, le contact os/implant est étroit, l’absence de ligament ne permet pas une dispersion de la charge sous forme de mobilité. La charge est essentiellement dissipée sous forme de contrainte. La mobilité, dans ce contexte d’interface os/implant, est néfaste pour la formation d’os néoformée.
Selon les contraintes (charge et amplitude) appliquées sur le système osseux, l’os va se remanier en réaction. Il s’agit de la loi de Wolf établie dès 1892. La masse osseuse augmente en fonction des stimulus mécaniques. Au-delà d’un certain seuil les contraintes entrainent une nécrose du tissu osseux et/ou fracture. La minimisation et la distribution des contraintes sont fondamentaux pour éviter la cratérisation.
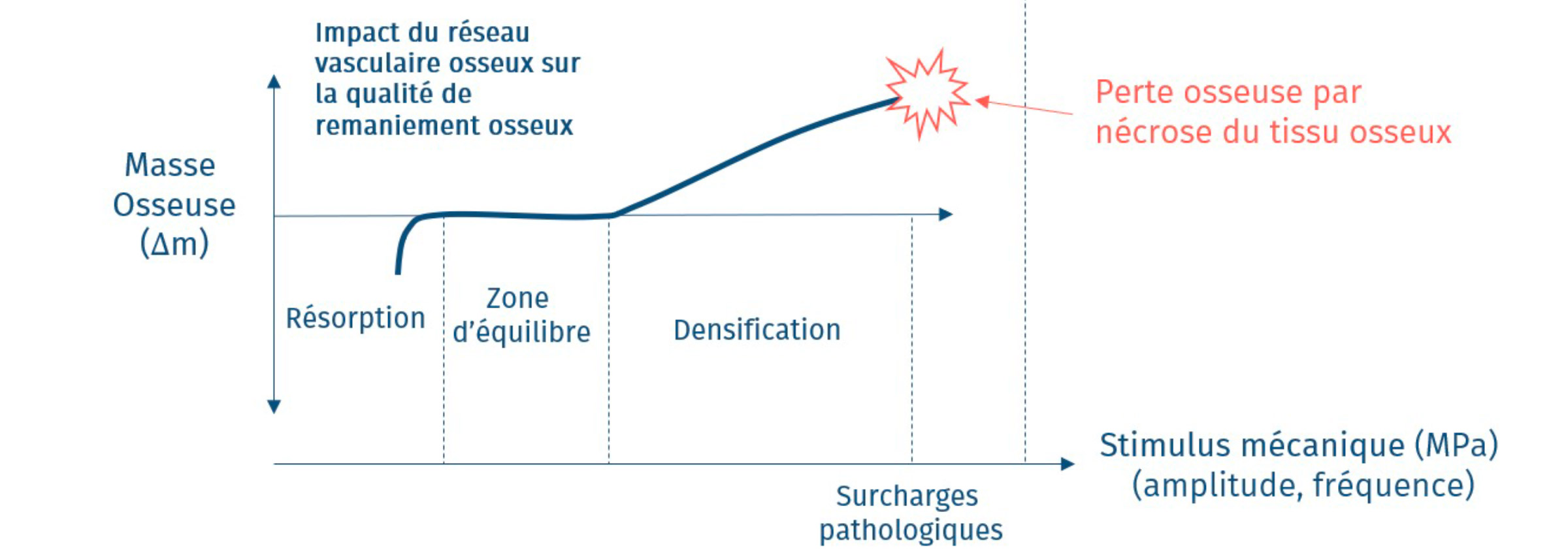
Figure 8 : Loi de Wolf complétée par les données de Lanyon et coll.1975 ; Cochran, 1982 ; Rubin et Lanyon, 1985 ; Frost, 1987 ; Martin et Burr, 1989 ; Burr et coll. 1996.
Une surcharge locale entraine une résorption osseuse et un relargage de particules due à la friction lors de l’insertion, tandis qu’une sous-charge entraine une mobilité et de fait une inflammation à cause de l’infection bactérienne (microgap). L’inflammation et la contamination bactérienne sont très largement associées à l’instabilité et ne sont pas exclusives à l’implantologie dentaire (interface stérile/, non stérile) puisqu’observées même dans les structures anatomiques fermées.
3. L’implant et la prothèse
3.1. La macrogéométrie
Des modifications de la conception de la géométrie multi-échelle de l’implant ont été suggérées pour augmenter le succès dans de l’os D4 pour un meilleur ancrage.
– La forme globale
Les études d’analyse par éléments finis des implants indiquent que les distributions et les amplitudes des contraintes osseuses varient en fonction de la forme de l’implant. L’implant cylindrique fut la première forme développée par Bränemark. Cette forme n’occupe pas suffisamment le volume disponible par la dent extraite et la compression est non progressive, ce qui entraine un échauffement rapide de l’os. A noter qu’une température au-delà de 41°C entraine une nécrose des cellules péri-implantaires.
L’implant conique fut ensuite mis au point, il se rapproche davantage de la forme d’une racine dentaire et occupe de fait le volume laissé par la dent extraite. Il permet par ailleurs d’éviter les obstacles anatomiques telles qu’une concavité vestibulaire ou encore le nerf mandibulaire. Son évolution est l’implant conique autoforant, il possède une rétention primaire de qualité, permettant son utilisation dans de nombreuses situations cliniques.
Enfin, l’implant cylindro-conique est caractérisé par une partie conique évasée au niveau crestal et une partie cylindrique apicale. Ces implants possèdent une bonne rétention primaire par compression crestale, mais peuvent néanmoins générer des contraintes excessives entrainant une perte osseuse marginale supérieure.
– Les filets
Transformer les forces de cisaillement en types de force plus forts à l’interface osseuse est l’objectif de l’incorporation de filets dans la conception de l’implant. Les filets sont également utilisés pour maximiser le contact initial, améliorer la stabilité initiale et favoriser la dissipation des contraintes interfaciales.
La profondeur du filet, l’épaisseur du filet, l’angle de face, le pas et l’angle d’hélice sont quelques-uns des motifs géométriques variables qui déterminent la surface fonctionnelle du filet Plusieurs conceptions de filetage ont été développées. L’implant Branemark originale, introduit en 1965, avait un motif de filetage en forme de « V ».
La conception originale a été modifiée au fil des ans pour permettre un placement plus simple et plus efficace et une meilleure répartition de la charge. Le filetage standard en « V », présente une charge de cisaillement sur l’os 10 fois supérieure à celle d’un filetage carré. La forme du filetage en contrefort inversé en « V » est optimisée pour les charges d’arrachement [6].
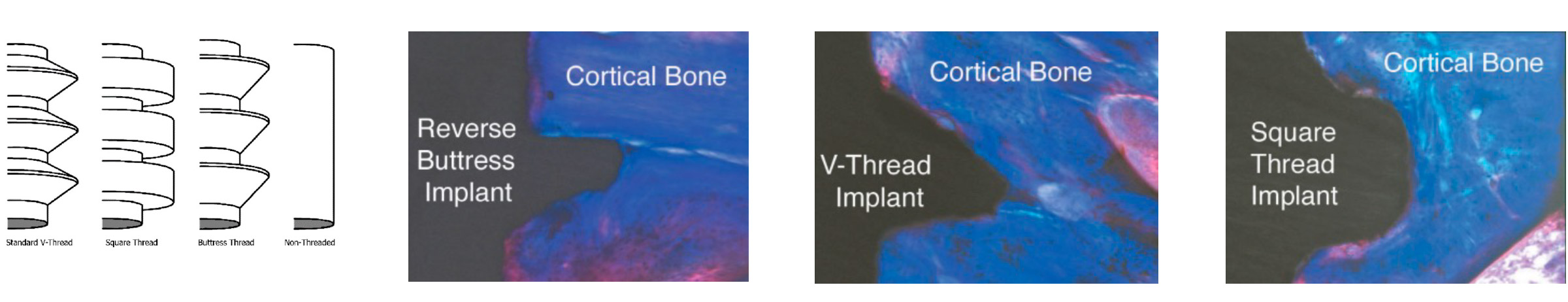
Figure 9 : Interface os/implant en fonction des trois formes de filetage [6]
La forme carrée du filet offre une surface optimisée pour la transmission de la charge de compression sur l’os.
Les résultats présentés figure 9 montrent les coupes histologiques de l’interface os/implant des trois formes de filets issues d’une étude animale et le tableau 2 montre les données quantitatives de torque et de contact os-implant. Sur l’ensemble des coupes, l’os cortical se développe entre les filets, épousant étroitement l’implant. L’aspect inférieur des filets était apposé par davantage d’os que l’aspect coronal. Les données quantitatives de cette étude suggèrent un avantage biologique et une meilleure stabilité pour les filets de formes carrées [6].
Il a été montré par ailleurs que l’ajout de microfilets dans le macrofilet est une stratégie efficace pour augmenter la surface de contact sans effet néfaste (§3.2 la texturation de surface) et de fait optimiser la transmission de la charge de compression.
3.2. La texturation de surface
Carlson et al [7] ont démontré une liaison biomécanique plus forte avec une surface d’implant rugueuse qu’avec une surface d’implant de forme similaire mais polie. D’autres études ont également rapporté qu’une surface rugueuse est plus adaptée à l’intégration de l’implant qu’une surface d’implant comparativement plus lisse, en démontrant un plus haut degré d’intégration osseuse. Bien que l’augmentation de la rugosité de la surface entraine une différenciation précoce des ostéoblastes, elle entraine surtout la génération de particules de titane par dégradation de la surface. Les particules de titane sont L’article de Silva et al. [6] le démontre (cf. figure 10). De fait, un couple d’insertion élevé pour un implant rugueux entraine plus de particules de relargage, actrices de l’inflammation chronique. Par ailleurs, Jordana et al. [8] ont réalisés en 2018 une revue systématique sur l’impact de l’état de surface et la prévalence des péri-implantites. Les résultats ont montré que le taux de péri-implantites dépend statistiquement des différences d’états de surfaces des implants et de la génération de particules de relargages.

Figure 10 : Evaluation mécanique des géométries des spires [6]
L’état de surface lisse permet d’augmenter le couple d’insertion sans produire de particules de titane. La stabilité primaire résultante est plus élevée et plus durable, ce qui favorise le repos mécanique nécessaire à l’ostéointégration, le risque d’une mobilité en deçà du seuil critique est décrue (cf figure 11). L’état de surface rugueux quant à lui, permet une stabilité secondaire plus rapide mais sous condition d’avoir une maitrise parfaite des produits de relargages d’autant plus critique pendant la phase de cicatrisation.
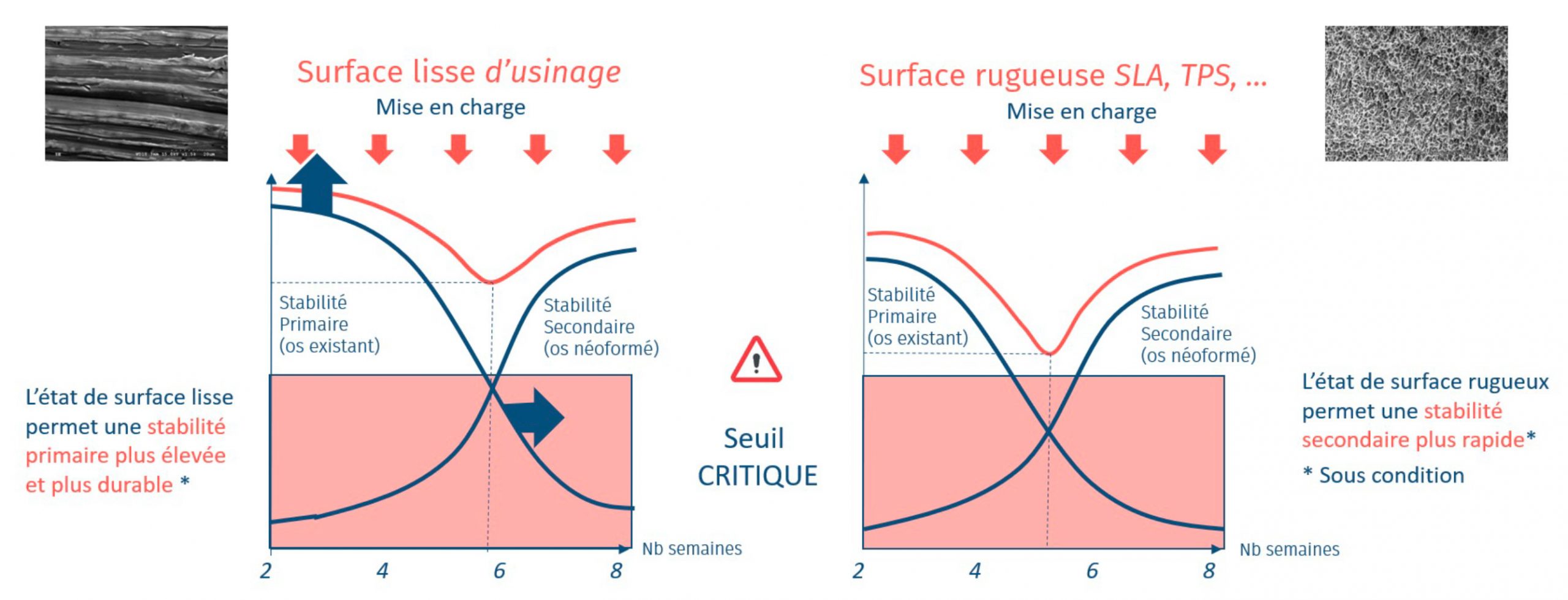
Figure 11 : Comparatif de la stabilité implantaire en fonction de l’état de surface de l’implant
3.3. L’orientation et le nombre d’implant
La contrainte de l’implant est également influencée par l’orientation du corps de l’implant [9]. Une charge appliquée le long de l’axe de l’implant diminue la contrainte maximale sur la région crestale comparé à un implant angulé. De fait quand la densité osseuse diminue, il est préconisé de placer l’implant le plus axial possible. Cette stratégie n’est pas forcément applicable dans certain cas notamment pour éviter des structures anatomiques sensibles ou pour trouver une accroche corticale au niveau de l’apex. De fait, la contrainte peut être également réduite de façon significative en augmentant la surface fonctionnelle S sur lesquelles les forces sont appliquées en plaçant plus d’implants.
La largeur de l’implant permet également de décroitre la contrainte par l’augmentation de la surface fonctionnelle S. Une augmentation de 0.5mm en diamètre permet une augmentation de la surface de 10-15%. Dans la mesure où les contraintes sont concentrées au niveau crestal, la largeur a plus d’impact que l’augmentation de la longueur. Des implants larges sont préconisés pour de l’os D4. Cela peut néanmoins nécessiter une augmentation volumique.
3.4. La prothèse
Une façon de réduire la charge biomécanique sur les implants est d’adapter la stratégie prothétique. La solidarisation de 5 implants permet de distribuer les forces occlusales et de réduire les contraintes maximales locales.
Le choix du matériau des armatures est également une stratégie efficace. Les articles scientifiques [10] corroborent le fait qu’outre la résistance mécanique, d‘autres propriétés mécaniques contribuent à la survie des reconstructions implanto-portées. Ces dernières étant sujet à des complications techniques en raison de l’absence de ligament parodontal et d’un comportement biomécanique critique.
Il est recommandé d’utiliser des matériaux avec un faible module élastique pour l’absorption des forces de compression et à la distribution des contraintes [10], [11] tel que le Zantex™. Ces propriétés mécaniques optimisées entraine une réduction de la transmission des contraintes sur l’os péri-implantaire notamment crestal [11], [12].
Dès lors que la situation clinique est difficile [10], il est fondamental d’utiliser ces stratégies prothétiques.
4. Le protocole d’implantation
Le protocole d’implantation a également une influence significative pour améliorer la stabilité primaire,
L’une des techniques chirurgicales proposées est la technique de forage sous-dimensionné. Elle consiste à optimiser localement la densité osseuse en utilisant un diamètre de forage final considérablement plus petit que le diamètre de l’implant [13]. De cette façon, un ajustement ostéocompressif entre la surface de l’implant et le lit osseux est obtenu.
La technique de l’ostéotome consiste quant à elle, de préparer un trou pilote de petite taille, puis de comprimer le tissu osseux latéralement et apicalement à l’aide d’un écarteur ou d’un instrument en forme d’implant [14]. La compression est indirecte comparée à la technique de sous-forage qui est directe.
En plus des techniques conventionnelles de préparation chirurgicale, la chirurgie osseuse piézoélectrique offre une technique alternative de pose d’implants par ultrasons. Actuellement, l’effet des ultrasons est largement étudié dans divers domaines de la médecine : en orthopédie, ils sont utilisés pour accélérer la guérison des fractures osseuses et des lésions ligamentaires en favorisant la prolifération cellulaire et la synthèse de la matrice osseuse. Les premiers rapports cliniques sont prometteurs en termes de précision et de sécurité [15].
Quelle est l’approche Victory ?
L’approche de Victory se base sur les dernières avancées scientifiques pour une gestion optimale des acteurs de la stabilité (cf. figure 12). Cette gestion s’appuie sur le principe suivant :
« Les spécificités du site implantaire doivent conditionner le plan de traitement »
Il s’agit dans un premier temps, d’évaluer les spécificités du site implantaire notamment la quantité osseuse disponible, la densité osseuse, l’épaisseur de la corticale et sa vascularisation. Cette évaluation passe par une analyse fine du site implantaire.
Dans un second temps il s’agit d’optimiser la qualité et la quantité osseuse par stimulation métabolique notamment par l’utilisation de l’ostéotenseur® rotatif ou manuel.
Et enfin, il s’agit d’adapter l’implant et le protocole d’implantation en fonction des spécificités du site implantaire.
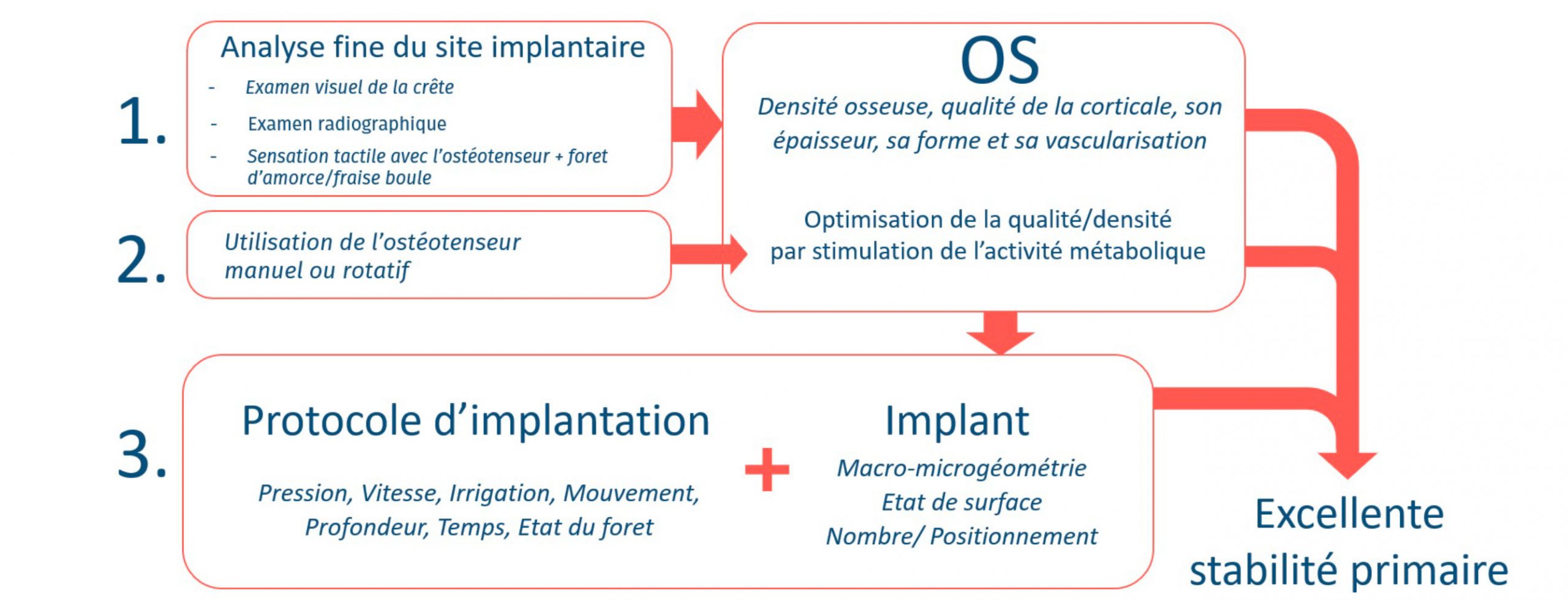
Figure 12 : Stratégie proposée par Victory pour une excellente stabilité primaire
1. Analyse fine du site implantaire
L’analyse du site implantaire se fait par un examen visuel de la crête, un examen radiographique et/ou cone beam pouvant être complété par une sensation tactile avec un foret d’amorce et avec l’ostéotenseur®. En effet, ce dernier peut s’utiliser comme une sonde transpariétale destinée à vérifier la qualité initiale du futur site osseux receveur (type D1, D2, D3, D4). Cela rassure le patient et fiabilise le futur geste chirurgical du praticien. L’Ostéotenseur® peut avantageusement être utilisé à la fois comme sonde surfacique et comme profondimètre transmatriciel. Il permet de vérifier l’adéquation des données de densités osseuses avec les relevés radiographiques et la reconstruction stéréolithographique.
2. Optimisation du site implantaire par l’ostéotenseur®
Cette optimisation est indiquée chaque fois que l’analyse radiologique montre un os de qualité inadéquate, soit parce qu’il est trop fragile (type D4) soit, au contraire, trop dense (type D1) (cf. figure 13).
L’optimisation du site implantaire par l’Ostéotenseur® s’explique par la mise en place de microtraumatismes ciblés, programmés et calibrés pré-implantologiques permettant d’initier l’ostéogénèse naturelle. Il permet ainsi d’obtenir des fonctions biomécaniques de l’os requises pour une implantologie reproductible, pérenne et sans risque pour le patient.
En cas d’os de type D4, le passage de l’Ostéotenseur® manuel permet de le transformer en os D2 actif au bout de 45 à 90 jours. Plusieurs impacts sont nécessaires pour couvrir l’ensemble des zones d’intérêts et doivent être espacés d’au moins 2mm. Cette technologie exclusive permet de densifier et consolider considérablement la matrice osseuse initiale par la formation de cals osseux réactionnels.
A l’opposé, un os cicatriciel hyper dense D1 sera rendu plus souple par l’ostéotenseur® rotatif. Au bout des 21 jours, l’os de type D1 sera transformé en type II actif, ce moment marque la fin de la phase catabolique post-traumatique.
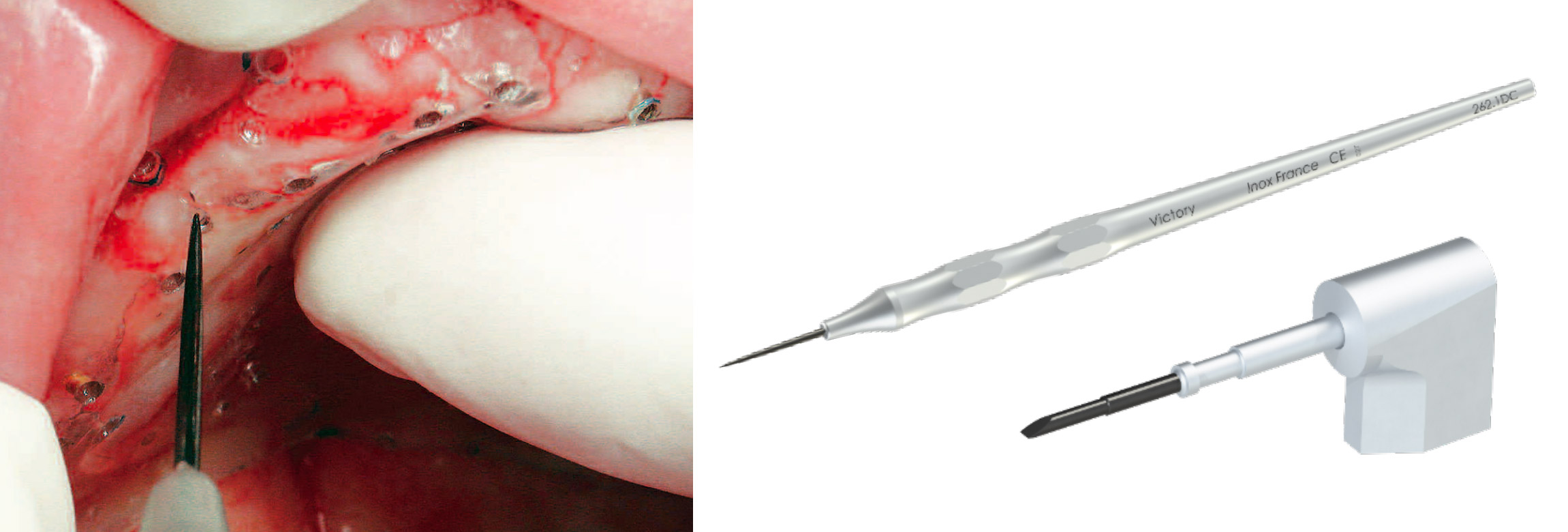
Figure 13 : Osteotenseur® manuel et rotatif
Dans la région sous sinusienne, l’Ostéotenseur® manuelle ou rotatif peut être utilisé pour faire une augmentation volumique au niveau sous sinusien. En effet, l’ostéotenseur en traversant la membrane de Schneider, va provoquer un saignement entre la membrane et le plancher du sinus.
Le caillot ainsi formé va s’amplifier in situ, provoquant une augmentation du site osseux concerné en 45 jours. Le gain varie de 2 à 8 mm.
3. Protocole d’implantation avec gestion des densité osseuses
Et enfin, il s’agit d’adapter l’implant et le protocole d’implantation en fonction des spécificités du site implantaire. Pour cela Victory a développé des protocoles de chirurgie simplifiés avec une gestion des densités osseuses spécifique à chaque implant. Ce développement passe notamment par la conception de forets à étages spécifiques à chaque implant avec un taux de compression en fonction de la densité osseuse comparé au protocole d’insertion classique (cf. figure 14 et 15). Le taux de compression est défini de la manière suivante :
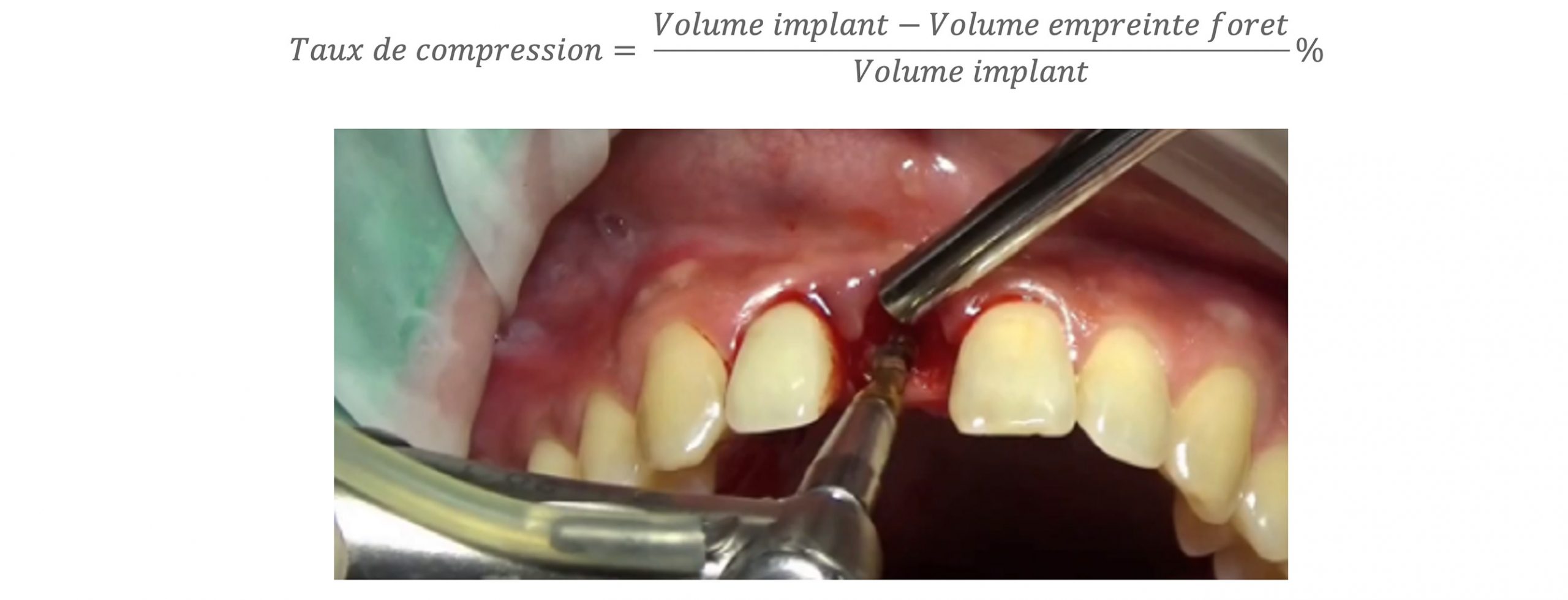
Figure 14 : Protocole d’insertion classique
Les protocoles avec les outils classiques ne donnent qu’une maitrise subjective de la rétention primaire avec des taux de compression aléatoires pouvant être très faibles jusqu’à 0%.
Figure 15 : Plan de recherche et dévelopement des protocoles d’implantation
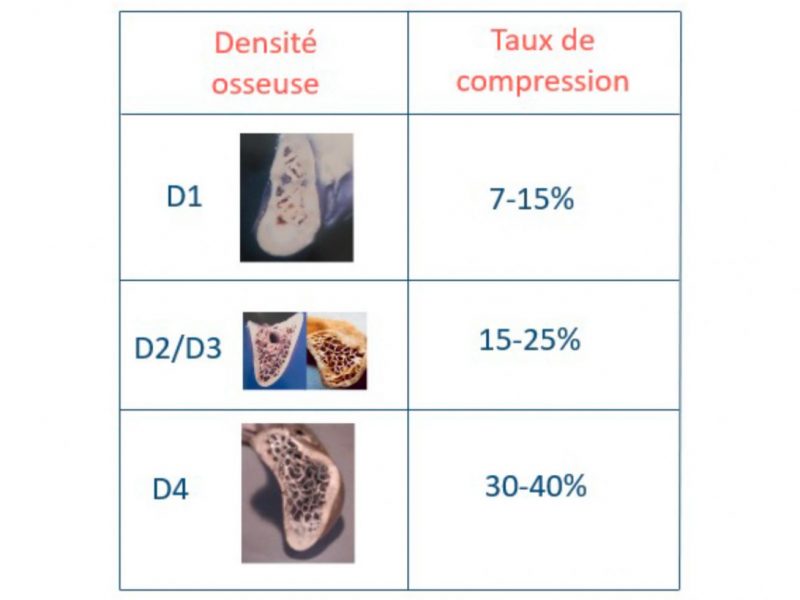
Tableau 3 : Taux de compression fonction de la densité osseuse
Pour une stabilité équivalente, la stratégie est d’adapter le taux de compression en fonction de la densité osseuse. Le taux de compression optimal par densité osseuse est indiqué dans le tableau 3.
Il est néanmoins fondamental d’alterner des zones de compression et de décompression pour une meilleure distribution des contraintes.
Le tableau 4 montre les résultats de taux de compression ainsi que les zones de compression et décompression pour l’implant Fractal Plus ø3.75h8 en fonction de chaque densité osseuse.
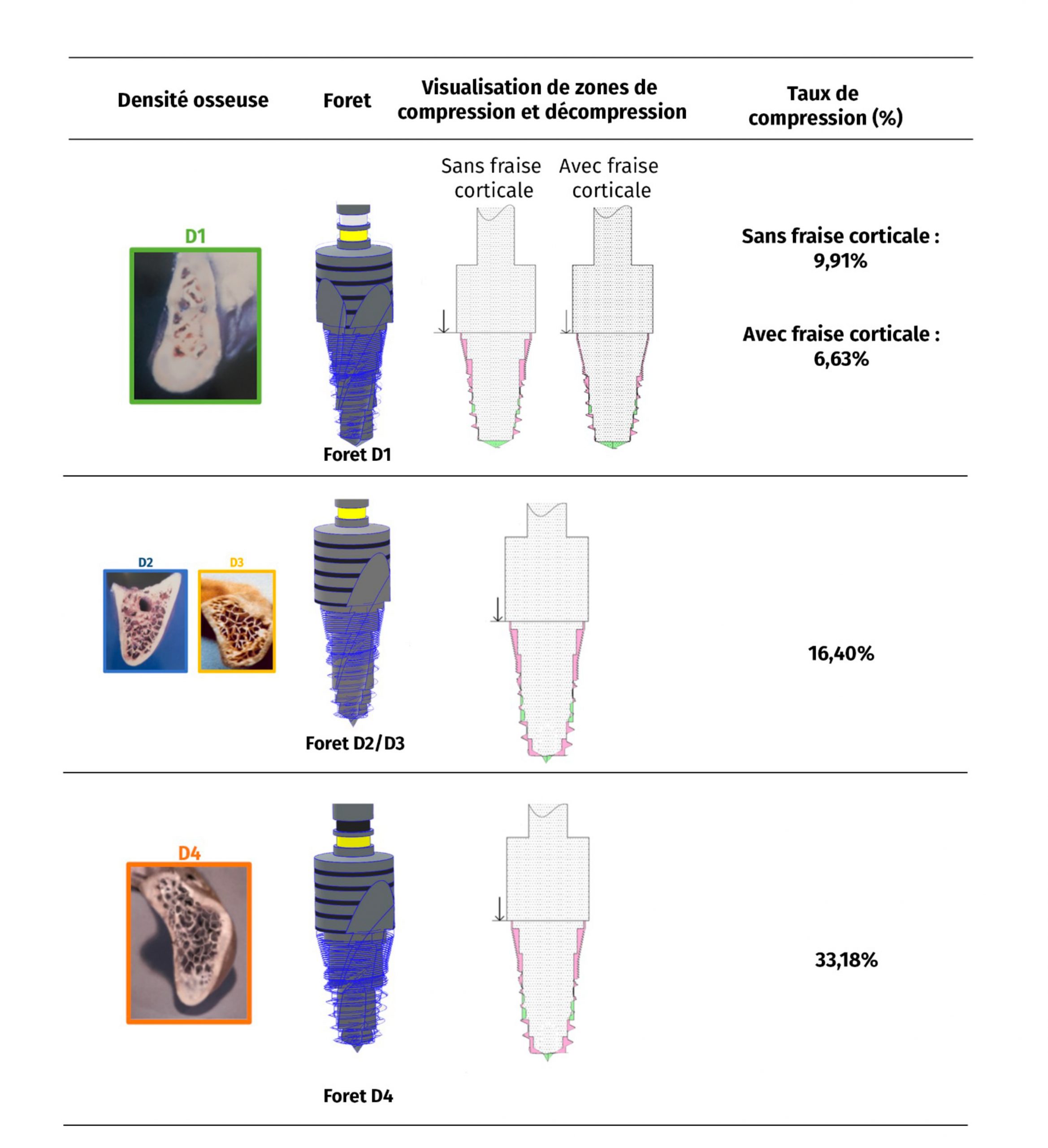
Tableau 4 : Taux de compression pour l’implant Fractal plus ø3.75 h 8mm en fonction des densité osseuse (zone de compression en rose, zone de décompression en vert)
Le tableau 5 présente les résultats de couple d’insertion dans des essences de bois pour simuler les densité osseuses. Les résultats confirment la stratégie d’augmenter le taux de compression en fonction de la densité pour maintenir un couple d’insertion stable. En effet l’insertion de l’implant OF1 avec un foret D4 sur du pin (simulant l’os D4) donne un taux de compression de 36.6% et un couple d’insertion de 90N.cm. Le foret D2/D3, donne un couple d’insertion de 92N.cm dans de la mélèze (os D2/D3) et le foret D1, 105N.cm dans du chêne (os D1). Le tableau montre également la variation de couple d’insertion lorsque le taux de compression n’est pas adapté à la densité osseuse ; perte néfaste de 12N.cm avec l’utilisation d’un foret D1 sur une simulation d’os D2/D3 et augmentation néfaste de 28N.cm avec l’utilisation d’un foret D4 sur une simulation d’os D2/D3.
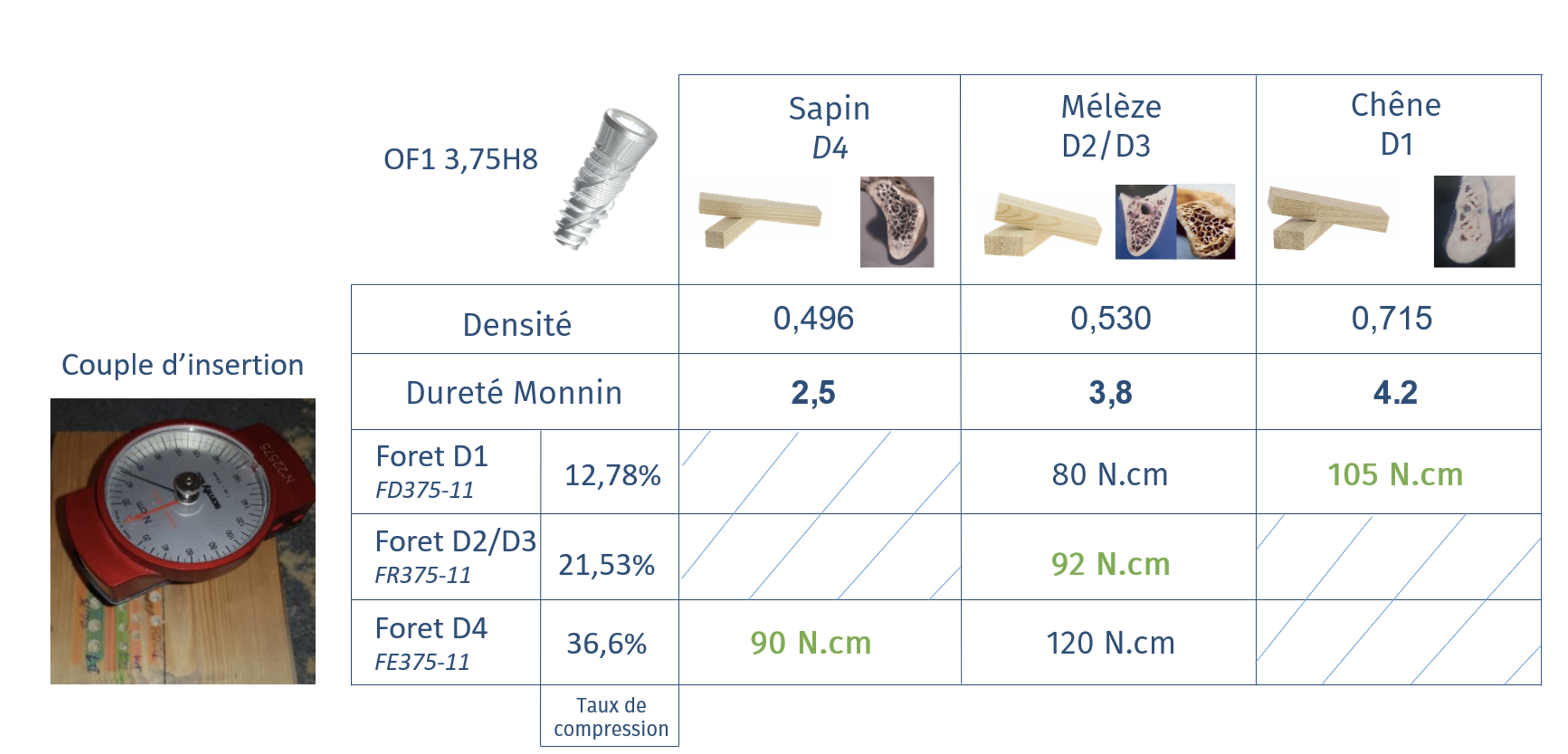
Tableau 5 : Valeur de couple d’insertion dans différentes essence de bois simulant les densités osseuses, exemple avec l’implant 3.75H8-OF1
Le tableau 6 présente les résultats de couple d’insertion dans des mandibule de porc. On observe une diminution du couple d’insertion fonction du taux de compression, la variabilité provient de la non-distinction des densités osseuses au préalable.


Tableau 6 : Valeur de couple d’insertion dans des mandibules de porc, exemple avec l’implant OF1 3.75H8
Enfin la figure 16 présente les essais sur sujets anatomiques. Les essais ont confirmé la meilleure précision de forage qu’avec la gamme précédante, la plus grande fermeté au vissage et l’assurance d’une stabilité primaire optimale.
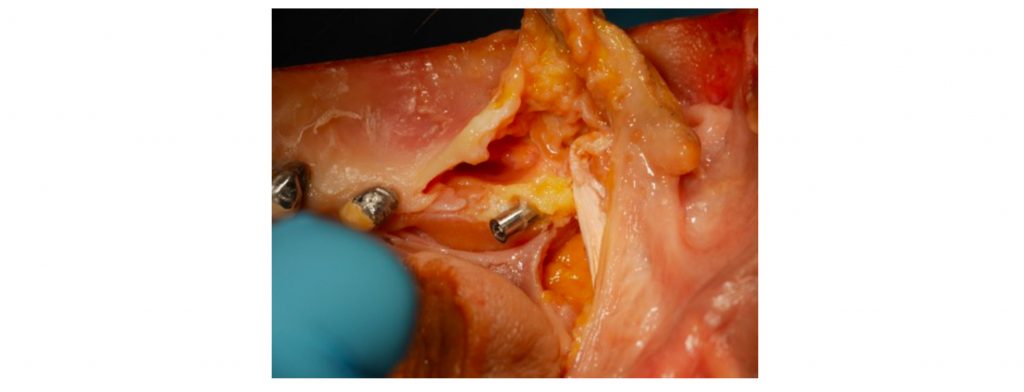
Figure 16 : Analyse des couples d’insertions sur sujet anatomique
Figure 17 : Trousse de chirurgie pour les gammes Fractal, Fractal plus et Fratex
Cette recherche a débouché sur l’élaboration d’une trousse de chirurgie simple et condensée pour trois implants avec la garantie d’une excellente stabilité primaire par une calibration optimale (cf. figure 17).

Augustin Lerebours
. Responsable Recherche Développement (PhD) chez Victory Implants
. Docteur en Biomécanique et biomatériaux
Thèse en Mécanique, Biomécanique et Biomatériaux Roberval-BMBI, France
Diplôme d’ingénieur Biomécanique Biomatériaux, Université de Technologie de Compiègne, France
Essayez enfin nos implants toutes surfaces lisses !
Implants Fractal® & Fratex®
20 implants achetés ➔ 1 trousse offerte

[1] C. Misch, “Density of bone: effect on treatment plans, surgical approach, healing, and progressive boen loading,” Int. J. oral Implantol. Implantol., vol. 6, no. 2, pp. 23–31, 1990, Accessed: Oct. 06, 2021. [Online]. Available: https://pubmed.ncbi.nlm.nih.gov/2073394/.
[2] T. Albrektsson and C. Johansson, “Osteoinduction, osteoconduction and osseointegration,” Eur. Spine J., vol. 10, pp. S96–S101, 2001, doi: 10.1007/S005860100282.
[3] W. Becker, “Immediate implant placement: diagnosis, treatment planning and treatment steps/or successful outcomes.,” J. Calif. Dent. Assoc., vol. 33, no. 4, pp. 303–310, 2005, Accessed: Oct. 01, 2021. [Online]. Available: https://europepmc.org/article/med/15915881.
[4] D. Carter and W. Hayes, “Bone compressive strength: the influence of density and strain rate,” Science (80-. )., vol. 194, no. 4270, pp. 1174–11176, 1976, doi: 10.1126/science.996549.
[5] I. Turkyilmaz, L. Sennerby, E. A. McGlumphy, and T. F. Tözüm, “Biomechanical aspects of primary implant stability: A human cadaver study,” Clin. Implant Dent. Relat. Res., vol. 11, no. 2, pp. 113–119, Jun. 2009, doi: 10.1111/J.1708-8208.2008.00097.X.
[6] J. Steigenga, K. Al-Shammari, C. Misch, F. H. Nociti, and H.-L. Wang, “Effects of Implant Thread Geometry on Percentage of Osseointegration and Resistance to Reverse Torque in the Tibia of Rabbits; Effects of Implant Thread Geometry on Percentage of Osseointegration and Resistance to Reverse Torque in the Tibia of Rabbits,” J Periodontol, vol. 75, pp. 1233–1241, 2004, doi: 10.1902/jop.2004.75.9.1233.
[7] L. Carlsson, T. Röstlund, B. Albrektsson, and T. Albrektsson, “Removal torques for polished and rough titanium implants.,” Int. J. Oral Maxillofac. Implants, vol. 3, no. 1, 1988, Accessed: Oct. 06, 2021. [Online]. Available: http://search.ebscohost.com/login.aspx?direct=true&profile=ehost&scope=site&authtype=crawler&jrnl=08822786&AN=37793332&h=%2BI6MI5EDkZVwnCs%2FO1gkC4ivriBcYnbxei1k8g%2F1x%2B1wCS3I%2FeTQZ72pDDKg3xQwhyifz%2BgN0WOupRE%2FXZBg3g%3D%3D&crl=c.
[8] F. Jordana, L. Susbielles, and J. Colat-Parros, “Periimplantitis and implant body roughness: A systematic review of literature,” Implant Dent., vol. 27, no. 6, pp. 672–681, 2018, doi: 10.1097/ID.0000000000000834.
[9] C. Misch and M. Bides, “Implant-protected occlusion.,” Int. J. Dent. Symp., vol. 2, no. 1, pp. 32–37, 1994, Accessed: Oct. 06, 2021. [Online]. Available: https://europepmc.org/article/med/9117850.
[10] E. Bonfante et al., “Reliability and failure modes of implant-supported Y-TZP and MCR three-unit bridges,” Clin. Implant Dent. Relat. Res., vol. 12, no. 3, pp. 235–243, 2010, doi: 10.1111/J.1708-8208.2009.00156.X.
[11] E. Erkmen, G. Meriç, A. Kurt, and A. Eser, “Biomechanical comparison of implant retained fixed partial dentures with fiber reinforced composite versus conventional metal frameworks: a 3D FEA study,” J. Mech. Behav. Biomed. Mater., vol. 4, no. 1, pp. 107–116, Jan. 2011, doi: 10.1016/J.JMBBM.2010.09.011.
[12] M. Menini et al., “Shock Absorption Capacity of Restorative Materials for Dental Implant Prostheses: An In Vitro Study,” Int. J. Prosthodont., vol. 26, no. 6, pp. 549–556, 2013, doi: 10.11607/IJP.3241.
[13] P. G. Coelho et al., “Biomechanical Evaluation of Undersized Drilling on Implant Biomechanical Stability at Early Implantation Times,” J. Oral Maxillofac. Surg., vol. 71, no. 2, pp. e69–e75, 2013, doi: 10.1016/J.JOMS.2012.10.008.
[14] D. Flanagan, “Osteotomy irrigation: Is it necessary?,” Implant Dent., vol. 19, no. 3, pp. 241–249, 2010, doi: 10.1097/ID.0B013E3181DC9852.
[15] J. A. Baker, S. Vora, L. Bairam, H. Kim, E. L. Davis, and S. Andreana, “Piezoelectric vs. conventional implant site preparation: ex vivo implant primary stability,” Clin. Oral Implants Res., vol. 23, no. 4, pp. 433–437, 2012, doi: 10.1111/J.1600-0501.2011.02286.X.

